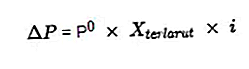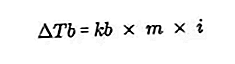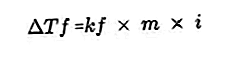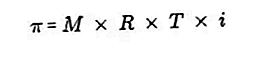Versuchen Sie darauf zu achten, was um uns herum mit Chemie zu tun hat? Am einfachsten ist die Luft, die wir atmen und die ein Gemisch aus Sauerstoff, Stickstoff und anderen Gasen enthält. Lebensmittelgewürze, Lebensmittelfarben und Lebensmittelkonservierungsmittel sind weitere Beispiele für Chemikalien, die sich in unserer Umgebung befinden. Die Chemie ist ein Zweig der Naturwissenschaften, den Sie in der Schule studieren werden, der verschiedene Materialien studiert. Ein Beispiel ist die Struktur der Materie, die Eigenschaften der Materie, die Materialform, Änderungen der Materie, die Klassifizierung der Materie, die Anordnung der Materie und die Energie, die damit einhergehen Änderungen. Nicht nur Mathematik und Physik, die Chemie hat auch verschiedene Arten von Formeln, wissen Sie. Es gibt viele chemische Formeln, aus denen Sie lernen werden, von kolligativen Eigenschaften bis hin zu Redoxreaktionen.
Bei dieser Gelegenheit lernen wir verschiedene chemische Formeln und Beispiele ihrer Probleme kennen, die Ihnen helfen, die Konzepte chemischer Formeln zu verstehen.
Chemische Formeln und Beispielprobleme
Das Vorhandensein von Formeln in der Chemie soll Forschern helfen, verschiedene Arten von experimentellen Ergebnissen zu finden, die durchgeführt werden sollen. Um diese Wissenschaft gut beherrschen zu können, müssen Sie einige chemische Formeln kennen, denen Sie beim Studium der Chemie häufig begegnen.
Formel für kolligative Eigenschaften von Lösungen
Die kolligative Natur einer Lösung ist eine Natur einer Lösung, die nicht von einer Art löslicher Substanz abhängt, sondern nur von der Konzentration der Partikel der Lösung. Dann bestehen die kolligativen Eigenschaften der Lösung aus zwei Arten von Eigenschaften, nämlich der kolligativen Natur der Elektrolytlösung und der kolligativen Natur der Nichtelektrolytlösung.
- Kolligative Eigenschaften von Nichtelektrolytlösungen
Obwohl die kolligative Natur eine Lösung beinhaltet, hängt die kolligative Natur nicht von der Wechselwirkung des gelösten Stoffs und der gelösten Moleküle ab, sondern von der Menge des in einer Lösung gelösten gelösten Stoffes. Kolligative Eigenschaften bestehen aus einer Abnahme des Dampfdrucks, einer Zunahme des Siedepunkts, einer Abnahme des Gefrierpunkts und einem osmotischen Druck. Jeder benötigt eine chemische Formel, um das Ergebnis zu erhalten.
- Dampfdruckabfallgleichung

Quelle: formel.co.id
- Die Gleichung für die Erhöhung des Siedepunktes
Der Siedepunkt einer Flüssigkeit ist die feste Temperatur, bei der sie siedet. Bei dieser Temperatur hat der Dampfdruck der Flüssigkeit eine Gleichung für den Luftdruck um sie herum und wird durch die Verdampfung aller Teile der Flüssigkeit verursacht. Der Siedepunkt einer Flüssigkeit kann durch einen Druck von 1 Atmosphäre gemessen werden.
Der Unterschied zwischen dem Siedepunkt einer Lösung und dem Siedepunkt eines reinen Lösungsmittels wird als Erhöhung des Siedepunkts bezeichnet. Die Gleichung für die Erhöhung des Siedepunkts lautet:

Quelle: formel.co.id
- Gefrierpunkt-Drop-Gleichung
Ein in Lösung vorhandener gelöster Stoff macht den Gefrierpunkt der Lösung kleiner als den Gefrierpunkt des Lösungsmittels. Gefrierpunktreduktionsgleichung:

Quelle: formel.co.id
- Osmotischer Druck
Der osmotische Druck ist eine Kraft, die erforderlich ist, um den Druck des Lösungsmittels von der semipermeablen Membran durch die Lösung auszugleichen.
Eine semipermeable Membran ist eine Membran, durch die Lösungsmittelmoleküle gelangen können, gelöste Stoffe jedoch nicht. Nach Van't Hoff wird die Lösung bei osmotischem Druck wie folgt formuliert:

Quelle: formel.co.id
- Kolligative Eigenschaften von Elektrolytlösungen
In der Konzentration der kolligativen Eigenschaften derselben Elektrolytlösung hat sie einen größeren Wert, wenn wir sie mit den kolligativen Eigenschaften der Nichtelektrolytlösung vergleichen. Wegen der großen Anzahl gelöster Partikel, die aus der Ionisationsreaktion der Elektrolytlösung resultieren, die im Van't Hoff-Faktor formuliert wurde.
Die Berechnung der kolligativen Eigenschaften einer Elektrolytlösung wird immer wie folgt mit dem Van't Hoff-Faktor multipliziert:

Quelle: formel.co.id
Einige der Formeln für die kolligativen Eigenschaften anderer Elektrolytlösungen sind:
- Dampfdruckabfall
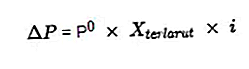
Quelle: formel.co.id
- Siedepunkterhöhung
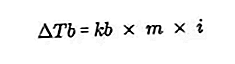
Quelle: formel.co.id
- Gefrierpunktabfall
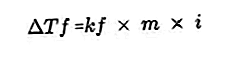
Quelle: formel.co.id
- Osmotischer Druck
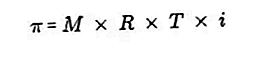
Quelle: formel.co.id
Molaritäts-, Molalitäts- und Molenbruchformeln
Molarität (M)
Die Molarität ist die Anzahl der Mol einer Substanz, die in 1 Liter Lösung gelöst ist.

Quelle: formel.co.id
M = Molarität
Mr = Molmasse des gelösten Stoffes (g / mol)
V = Volumen der Lösung
Molalität (m)
Die Molalität ist die Molzahl der in 1 kg Lösungsmittel gelösten Substanz. Die chemische Formel lautet wie folgt.

Quelle: formel.co.id
m = Molalität (mol / kg)
Mr = Molmasse des gelösten Stoffes (g / mol)
Masse = Masse des gelösten Stoffes (g)
P = Masse des Lösungsmittels (g)
Molenbruch
Der Molenbruch ist eine Konzentrationseinheit, in der alle Komponenten der Lösung auf der Basis von Mol berechnet werden.

Quelle: formel.co.id
xi = Anzahl der Mol
i, j, xj = Molenbruch
Beispiele für chemische Formelprobleme
1. Wenn der osmotische Druck von 500 ml Fructoselösung C6H12O6 ab 32 ° C 2 atm beträgt, beträgt die Masse der gelösten Fructose?
Lösung:

2. In der Molfraktion der Harnstofflösung in Wasser 0,2. Der Sättigungsdampfdruck von reinem Wasser mit einer Temperatur von 20 ° C beträgt 17,5 mmHg. Dann ist bei dem gesättigten Dampfdruck der Lösung bei der folgenden Temperatur?
X.Harnstoff + X.Wasser = 1
0,2 + X.Wasser = 1
X.Wasser = 0,8
P.Lösung = X.Wasser x P. Wasser
P.Lösung = 0,8 × 17,5 mmHg
P.Lösung = 14 mmHg
Dies sind einige chemische Formeln, die Sie lernen können, um die Beantwortung verschiedener chemischer Fragen zu erleichtern. Wenn Sie der Meinung sind, dass diese Formeln nicht ausreichen, können Sie das PROBLEM-Produkt ausprobieren, eine gewichtete, vollständige Online-Lösung zum Üben von Fragen in Smart Class wie Trigonometrie, Limit, Logarithmus und vielen mehr. Angefangen von der Grundschule über die Mittelstufe bis hin zur Oberstufe mit verschiedenen Fächern wie Mathematik, Physik, Chemie und anderen. Hier können Sie verschiedene Arten von Formeln mit Beispielproblemen lernen.
Komm schon, worauf wartest du noch? Probieren wir jetzt PROBLEM-Übungen in Smart Class aus.